12月21日,beat365正版唯一巴斯德學院Adjunct professor孟廣勳和Dimitri Lavillette合作在國際學術期刊《美國國家科學院院刊》發表了研究論文SARS-CoV-2 spike engagement of ACE2 primes S2’ site cleavage and fusion initiation。

由新冠病毒(SARS-CoV-2)感染引起的新冠肺炎(COVID-19)大流行在全球範圍内已造成超過2.75億例感染。SARS-CoV-2刺突(Spike)蛋白在功能上不僅負責識别宿主細胞上的受體,同時還會介導細胞膜與病毒包膜融合,從而導緻病毒感染宿主細胞。目前全球流行的突變株在刺突蛋白上有多處突變發生,給疫苗的更新和設計都帶來極大挑戰。雖然目前已經發現宿主血管緊張素轉換酶2(ACE2)蛋白與病毒Spike刺突蛋白結合,但結合後的分子事件與細胞機制還不明了。因此,闡明Spike蛋白與ACE2受體結合後下遊的分子和細胞機制或是遏制當前大流行和預防未來冠狀病毒爆發的一個研究重點。
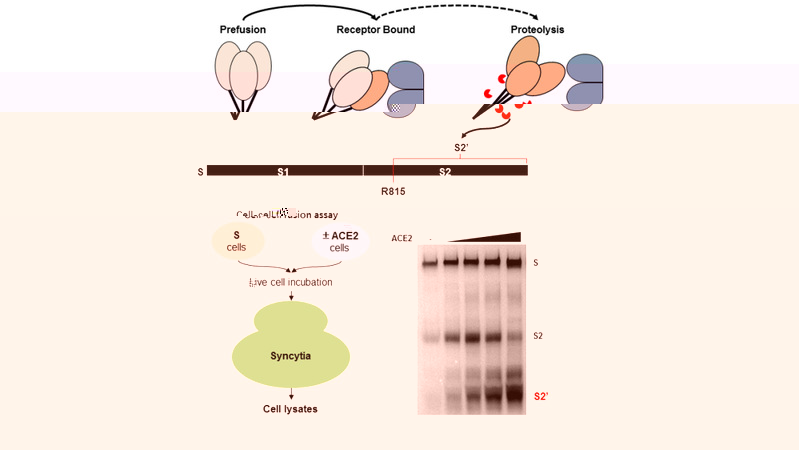
SARS-CoV-2 S蛋白單體包含兩個片段:氨基末端的S1亞基中包含一個受體結合域(RBD),它識别宿主ACE2受體進行初始對接;而羧基末端S2亞基催化病毒和細胞膜的融合,使随後的病毒RNA基因組進入受感染細胞内進行**。在本研究中,科研人員通過細胞-細胞融合系統和假病毒感染模型,發現刺突蛋白結合受體後,會在細胞中啟動蛋白酶切反應,導緻S2’片段生成和膜融合現象。如果替換掉刺突蛋白的S2’切割位點,則能夠有效抑制多種流行株的刺突蛋白(如Alpha,Beta和Delta等)誘導的細胞膜融合反應。因此,刺突蛋白感染過程中的S2’切割是新冠病毒感染過程中不可或缺的分子事件之一。
該項研究工作主要由上海巴斯德所博士後喻實、博士研究生鄭旭等在孟廣勳與Dimitri Lavillette研究員的共同指導下完成;上海巴斯德所王頌基研究員合作參與了本項研究。該研究得到中國博士後基金、國家自然科學基金、中科院、上海市、科技部的經費支持。
論文鍊接:
https://www.pnas.org/content/119/1/e2111199119
